参 考 资 料
一、主要课外阅读文献
1、傅献彩主编,大学化学,北京:高等教育出版社,1999
2、天津大学无机化学教研室编,无机化学,第三版,北京:高等教育出版社,2002
3、华东理工大学分析化学教研组等编,分析化学,第五版,北京:高等教育出版社,2003
二、课外阅读参考文献
1、 唐有祺,化学之继往开来,大学化学,1990,5(5),1
2、 戴安邦,无机化学的复兴和发展,大学化学,1988,3(1),1
3、 陈懿、楼南泉,智慧·勤奋·谦虚·热诚——访1986年诺贝尔化学奖获得者李远哲教授,大学化学,1987,2(2),1
4、 吴文健、胡碧如,诺贝尔奖与现代化学发展,大学化学,1998,13(4),55
5、 高鸿,分析化学的现状和未来,大学化学,1991,6(3),3
6、 周同惠,兴奋剂检测,大学化学,1990,5(4),1
7、 漫谈绿色化学;王恩举;《大学化学》2002,4(24)。
8、 固氮酶与化学模拟生物固氮;朱文祥,马淑兰,郭倩玲;《化学教育》2002,4(3)。
9、 汪群拥,尹占兰,略论现代酸碱理论的发展,大学化学,1991,6(1),13
10、高能电池----当代化学电源;王毓明,王坚;《大学化学》2000,5(29)
11、太阳能电池的新进展;黄宝圣;《化学教育》2002,7(7)
12、杨骏英、华彤文,环境化学知识可以渗入普通化学,大学化学,1994,(5)
13、郭宝章,配位化学的奠基人——维尔纳A.Werner,化学教育,1981,(6),37
14、焰火的化学,无机化学(第四版),高等教育出版社,2001年。
课 程 大 纲
课程性质:基础课
适用专业:食品科学与工程
总学时:48
一、课程的学习目的和意义
“无机及分析化学”课程是高等工业学校化工、轻工、食品科学和工程、生物化学与生物工程、材料科学、应用化学等有关近化类专业及农林医等院校相近专业课程体系中必修的第一门化学基础课。它是培养上述几类专业工程技术人才的整体知识结构及能力结构的重要组成部分,同时也是后继化学课程的基础。
本课程以教育部化学课程教学指导委员会提出的《高等学校无机及分析化学课程教学基本要求》为依据,贯彻“少而精、精而新”的原则,努力做到“削枝强干、去粗存精、突出重点、加强基础” ,并为后继课程提供强有力的化学知识支撑。具有食品、轻工类专业的鲜明特色。
本课程的基本任务,是通过课堂讲授,并与无机及分析化学实验课程密切结合,使学生掌握物质结构的基础理论、化学反应的基本原理及其应用、元素化学的基本知识、化学分析的基本原理与方法,培养学生运用无机及分析化学的理论去解决一般无机及分析化学问题的能力,初步具有查阅和自学一般无机及分析化学书刊、选择正确的分析测试方法,以及正确判断、表达分析测试结果的能力,为解决工农业生产与科学研究的实际问题打下一定的基础。
本课程将力图符合社会对相应专业人才素质、知识、能力培养的需求,强化早期渗透应用意识,扩展学生视野和知识点,以有利于学生分析问题、解决问题能力的培养,初步激活学生创新思想,培养学生创新精神。
二、课程内容
第1章绪论(1学时)
(一)教学目的与要求
介绍化学研究的对象与内容、“无机及分析化学”课程的主要内容及学习方法
(二)重点与难点
(三)教学内容
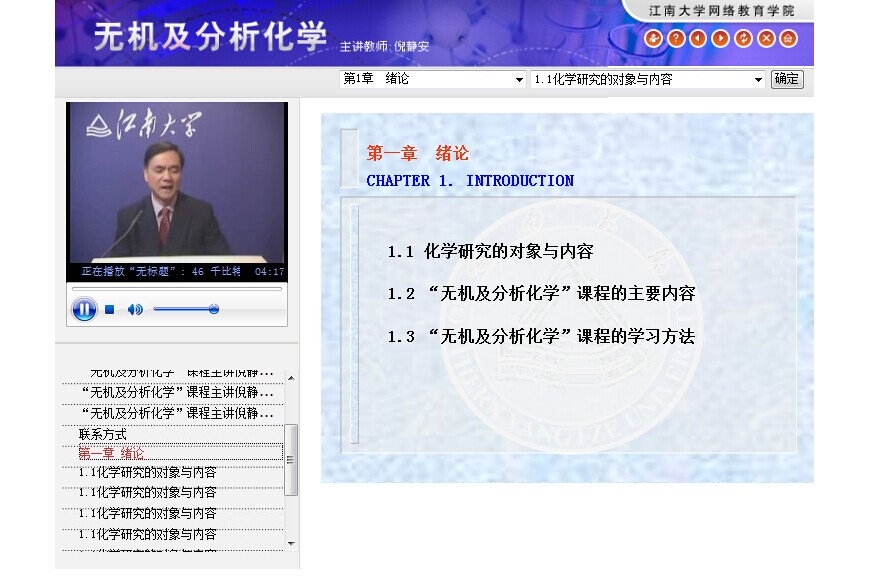
1.1化学研究的对象与内容
1.2 “无机及分析化学”课程的主要内容
1.3“无机及分析化学”课程的学习方法
第2章 化学中的基本计量(3学时)
(一)教学目的与要求
了解化学中的计量。掌握化学中的浓度表示法和化学计算。掌握溶液中各种常见浓度的表示法的应用和相互之间的换算。
了解滴定分析过程和滴定方式。掌握滴定终点、化学计量点、终点误差、指示剂、标准溶液及其配制、基准物质、标定等滴定分析中的重要基本概念。掌握滴定分析对化学反应的要求。
掌握误差基本知识及产生原因、减免方法,掌握误差与偏差的各种表示方法及有关计算。明确准确度与精密度的意义及二者之间的相互关系,了解提高分析结果准确度的方法。
正确了解有效数字,掌握有效数字的运算规则。
(二)重点与难点
重点:溶液的浓度。
“量”的概念及应用(误差与有效数字、测定结果的正确表达)。
(三)教学内容
2.1化学中的计量与化学计算
2.2误差与有效数字
第3章 化学反应的基本原理(3学时)
(一)教学目的与要求
了解反应达到化学平衡的特征,理解化学平衡的概念,能够准确写出化学平衡常数表达式,掌握平衡常数的有关计算。掌握化学平衡的移动规律,掌握化学平衡移动后平衡组分的有关计算。
(二)重点与难点
重点:标准平衡常数的表达式和有关化学平衡的计算。化学反应方向的判断,浓度、压力对化学平衡的影响。
(三)教学内容
3.1 化学反应进行的限度
第4章 酸碱与酸碱平衡(8学时)
(一)教学目的与要求
掌握酸碱质子理论、酸碱及其共轭关系、酸碱强弱及其衡量、KaΘ与KbΘ的关系、溶液的酸碱性和pH值、离解平衡(含分级的离解平衡)及其影响因素(解离度、稀释定律、同离子效应)。了解活度与离子强度,理解弱电解质溶液中平衡组成计算。熟悉质子条件,能计算一元弱酸(碱)、多元酸(碱)、两性物质、弱酸及其共轭碱混合体系的pH值。掌握缓冲溶液的基本原理,理解缓冲能力及缓冲溶液选择。
掌握酸碱滴定法的基本原理,了解化学计量点的计算、影响pH突跃的主要因素。掌握酸碱指示剂作用原理,理解变色范围及其影响因素。了解混合指示剂。掌握指示剂的选择原则、实现准确滴定的条件以及终点误差的分析。了解多元酸(碱)滴定的特点,理解分步滴定的条件与原理,掌握酸碱滴定的应用与结果计算。
(二)重点与难点
重点:酸碱平衡及其应用(酸度计算、控制、检测、组成测定及结果计算)。
难点:质子条件式确定及其应用([H+]计算式获得)。
(三)教学内容
4.1酸碱质子理论与酸碱平衡
4.2酸碱平衡的移动
4.3酸碱平衡中组分浓度的计算
4.4溶液酸度的计算
4.5溶液酸度的控制与检测
4.6酸碱滴定法
第5章 沉淀的形成与沉淀平衡(3.5学时)
(一)教学目的与要求
掌握沉淀生成与溶解平衡、溶解度与溶度积的相互换算、溶度积规则及应用。理解影响沉淀溶解度的主要因素(同离子效应、酸度等),了解盐效应等。
掌握分步沉淀及其应用,了解沉淀转化。
(二)重点与难点
重点:影响沉淀溶解度的主要因素及其应用(沉淀与溶解、分离等);获得纯净、良好沉淀的条件;重量分析结果计算。
难点:影响沉淀溶解度的主要因素的具体应用。
(三)教学内容
5.1 沉淀的生成与溶解平衡
5.2 沉淀的溶解、分步沉淀与沉淀的转化
第6章 电化学与氧化还原平衡(7学时)
(一)教学目的与要求
了解原电池、电极电势、标准电极电势的定义,在掌握氧化值法配平氧化还原反应方程式的基础上,熟练掌握离子电子法配平氧化还原反应方程式。掌握影响电极电势的因素,熟练运用能斯特方程式进行有关计算。
能够利用电极电势比较氧化剂和还原剂的相对强弱,判断氧化还原反应的方向,确定氧化还原反应的限度,计算溶度积常数或pH值以及化学平衡常数。掌握元素电极电势图的意义及其应用。
(二)重点与难点
重点:电极电势及其影响因素、具体应用;氧化还原滴定法原理、常用方法及条件、测定结果计算。
难点:影响电极电势主要因素的具体应用,条件电极电势。
(三)教学内容
6.1 氧化还原反应与电极电势
6.2 影响电极电势的主要因素
6.3 电极电势的应用
第7章 原子结构(3.5学时)
(一)教学目的与要求
了解氢原子光谱和原子能级的概念,了解核外电子运动的特殊性——波粒二象性。
了解原子轨道(波函数)和电子云等原子核外电子运动的近代概念,理解s、p、d原子轨道(波函数)角度分布图、电子云角度分布图,并掌握其分布特征。
掌握四个量子数,熟悉四个量子数对核外电子运动状态的描述及其名称、符号、取值和意义。掌握电子层、电子亚层、能级和轨道等概念的含义,熟悉s、p、d原子轨道的形状和空间伸展方向。
掌握多电子原子核外电子分布的一般规律,能熟练运用保里(Pauli)不相容原理,能量最低原理和洪特(Hund)规则,正确写出一般元素(原子序数1-36号)的核外电子排布式和价电子构型,并能确定它们在周期表中的位置。
掌握主族元素、过渡元素各族价电子层结构的特征,掌握原子结构和元素周期表中元素按s、p、d、ds、f分区的关系。
会从原子半径、电子层构型和有效核电荷来了解元素的性质,了解电离能、电子亲合能、电负性的周期性变化规律。
本课程在学习原子结构这一章时,只要求能用所得结论来分析元素及其化合物性质的内在原因,不必追究这些结论是如何推导来的。
(二)重点与难点
重点:原子核外电子运动状态及电子排布;原子结构与性质的关系,元素性质的周期性变化。
难点:原子核外电子运动状态的描述(波粒二象性、波函数、概率分布、电子云)。
(三)教学内容
7.1 原子结构基本模型
7.2 多电子原子结构
7.3元素周期系
第8章 分子结构与晶体结构(6学时)
(一)教学目的与要求
理解三种重要化学键(共价键、离子键、金属键)的形成、本质及其性质。能够用化学键理论判断简单无机化合物的结构和性质。
重点从价键理论理解共价键的形成、主要特征(方向性和饱和性)、主要类型(σ键和π键)。熟悉杂化轨道理论,掌握杂化轨道的概念和主要杂化轨道类型(sp、sp2、sp3)的形成及与一些典型分子或离子几何构型之间的关系。
了解键参数、共价键的极性和分子的极性。理解分子的偶极矩、变形性及其变化规律。理解分子间力、氢键的产生及其对物质性质的影响。
了解离子键的形成及其主要特征(无方向性、无饱和性),理解离子的电子构型、离子极化对物质性质的影响。
从自由电子概念了解金属键的形成和主要特征(无方向性、无饱和性)。会用金属键说明金属的共性(光泽、延展性、导电和导热性)。
理解四种不同类型晶体的特征(分子晶体、原子晶体、离子晶体、金属晶体)及其与物质熔点、沸点、硬度等物理特性的大致关系。
(二)重点与难点
重点:共价键的特征及类型;杂化类型及空间构型;分子间力和氢键的特点及对物质性质影响。
难点:杂化轨道形成。
(三)教学内容
8.1共价键与分子的几何构型
8.2分子间力和氢键
8.3 晶体结构
第9章 配合物与配位平衡(4学时)
(一)教学目的与要求
掌握无机配合物概念、组成和命名。
掌握配位平衡的基本理论及应用,了解配位平衡与酸碱、沉淀、氧化还原等平衡间的相互影响,能进行相关离子浓度的计算。
(二)重点与难点
重点:配合物命名,配位平衡及其应用(稳定常数、影响配位平衡的主要因素及计算)。
难点:影响配位平衡主要因素。
(三)教学内容
9.1 配合物与螯合物
9.2配位平衡及其影响因素
第10章 主族元素选论(6学时)
(一)教学目的与要求
掌握碱金属 、碱土金属单质和重要化合物(氧化物、氢氧化物等)的典型性质,熟悉卤素、氧、硫、氮族元素、碳、硅、锡、铅、硼、铝的单质和重要化合物(氧化物、卤化物、氢化物、硫化物、氢氧化物、含氧酸及其盐等)的性质,理解元素酸碱性、氧化还原性在周期表中的变化规律,会判断一般化学反应的产物,并能正确书写反应方程式。
(二)重点与难点
常见主要元素,特别是那些元素的主要化合物的酸碱性、氧化还原性、热稳定性等性质及其变化规律。
(三)教学内容
10.1 碱金属和碱土金属
10.2 硼、碳族元素及其主要化合物
10.3 氮族元素及其主要化合物
10.4 氧族元素及其主要化合物
10.5卤素及其主要化合物
第11章 副族元素选论(3学时)
(一)教学目的与要求
掌握过渡元素的通性,侧重学习铬、锰、铁、钴、镍、铜、银、锌、镉、汞等过渡元素单质、重要化合物、配合物的典型性质。会判断一般化学反应的产物,并能正确书写反应方程式。
(二)重点与难点
ds、d区常见主要元素,特别是,常见金属离子的鉴定。
(三)教学内容
11.1 过渡元素通性
11.2 d区常见元素及其主要化合物
11.3 ds区常见元素及其主要化合物
三、学时分配
第1章绪论 1.1化学研究的对象与内容 1.2 “无机及分析化学”课程的主要内容 1.3“无机及分析化学”课程的学习方法 |
1学时 |
第2章 化学中的基本计量 2.1化学中的计量与化学计算 2.2误差与有效数字 |
3学时 |
第3章 化学反应的基本原理 3.1 化学反应进行的限度 | 3学时 |
第4章 酸碱与酸碱平衡 4.1酸碱质子理论与酸碱平衡 4.2酸碱平衡的移动 4.3酸碱平衡中组分浓度的计算 4.4溶液酸度的计算 4.5溶液酸度的控制与检测 4.6酸碱滴定法 |
8学时 |
第5章 沉淀的形成与沉淀平衡 5.1 沉淀的生成与溶解平衡 5.2 沉淀的溶解、分步沉淀与沉淀的转化 |
3.5学时 |
第6章 电化学基础与氧化还原平衡 6.1 氧化还原反应与电极电势 6.2 影响电极电势的主要因素 6.3 电极电势的应用 |
7学时 |
第7章 原子结构 7.1 原子结构基本模型 7.2 多电子原子结构 7.3元素周期系 |
3.5学时 |
第8章 分子结构与晶体结构 8.1共价键与分子的几何构型 8.2分子间力和氢键 8.3 晶体结构 |
6学时 |
第9章 配合物与配位平衡 9.1 配合物与螯合物 9.2配位平衡及其影响因素 |
4学时 |
第10章 主族元素选论 10.1 碱金属和碱土金属 10.2 硼、碳族元素及其主要化合物 10.3 氮族元素及其主要化合物 10.4 氧族元素及其主要化合物 10.5卤素及其主要化合物 |
6学时 |
第11章 副族元素选论 11.1 过渡元素通性 11.2 d区常见元素及其主要化合物 11.3 ds区常见元素及其主要化合物 |
3学时 |
总学时 | 48学时 |